会员资料“各单元化学方程式汇总”或者“重点化学方程式”已按照北京中考要求整理完毕!
5.2 化学反应方程式
一、认识化学方程式
一切化学变化都遵循 质量守恒定律 ;
化学反应前后物质的总质量 相等 ;
问题:下面是木炭在氧气中燃烧燃烧生成二氧化碳的微观变化示意图:
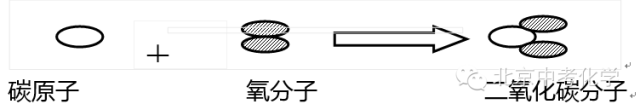
你能用化学式并体现质量守恒定律写出一个表示该化学反应的式子吗?
。
答案:C+O2=点燃=CO2
解析:根据反应前后“原子种类”和“原子个数”不变,可以看出,以上式子符合“质量守恒定律”。
该式子就是碳燃烧的化学反应方程式(简称:化学方程式,最简称:方程式)
根据:化学方程式“C+O2=点燃=CO2”表达的意义有哪些?
1.表示反应物是碳和氧气 ;(说明,C有三种含义碳和氧化铜反应的化学方程式,其中表示物质的含义是“碳”单质)
2.表示生成物是 二氧化碳 ;
3.表示反应条件是 点燃 ;
4.质: 碳 和氧气 在 点燃 的条件下反应生成 二氧化碳 ;
5.量:每 12 份质量的碳和 32 份质量的氧气完全反应碳和氧化铜反应的化学方程式,生成 44 份质量的二氧化碳;
6.粒子:每 1 个碳原子和 1 个氧分子反应,生成 1 个二氧化碳分子
二、化学方程式的定义:
1、用 化学式 等国际通用的化学语言来表示“化学反应”的式子叫做化学方程式。
(注:方程式表示:反应。化学式表示:物质组成。二者易于混淆。)
书写化学方程式应遵循的原则
⑴____客观事实__
(注意点:化学式不能写错)
⑵___质量守恒___
(注意点:需要配平,使得左右原子种类个数相等)
2、化学方程式提供的信息包括:
①哪些物质 参加 反应;(等号前面的物质为反应物)
②通过什么 条件 反应;(没有写明条件时,条件为:常温常压下进行)
③反应生成了哪些物质;(等号后面的物质为生成物)
④参加反应的各粒子的 个数比(化学计量数之比) ;(就是化学式前面的系数比)
⑤反应物、生成物间的 质量 份数比;(就是相对分子质量与系数相乘之比)
⑥反应前后质量守恒,等等。
三、读法:
将化学方程式““C+O2=点燃=CO2”读一读。(C-12 O-12)
1宏观读作:
碳和氧气在点燃条件下生成二氧化碳 ;(一般就只读宏观含义)
2.微观读作:
1个碳原子和1个氧分子在点燃条件下生成1个二氧化碳分子 ;
3.从量的方面读作:
每12份质量的碳和32份质量的氧气反应,生成44份质量的二氧化碳 。
注:
1、化学方程式中的下列符号表示的意义?
“+”___和___
“=”__生成__
“△”_加热__(只有加热有符号,其他条件需书写汉字)
“↓”_沉淀__(在液体反应中生成难溶固体才书写)
“↑”_气体__(反应物中无气体,生成物中有气体才书写)
2、为了体现质量守恒定律,书写化学方程式时,一定要__配平___
3、配平化学方程式时,添加的化学计量数是添在_化学式_前,绝不能改动__化学式____。
4、箭头“↓”、“↑”是__生成物_物状态的符号,只能标在_生成_物中,不能标在__反应物__物中。
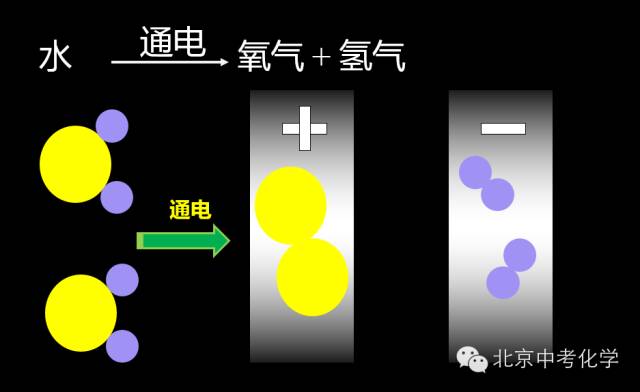
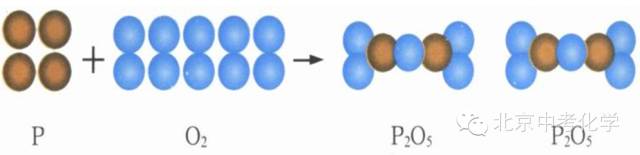
练习:按照以上内容分析如下两个图示的反应
1、电解水
2、红磷燃烧
及时巩固:根据课本P97讨论内容先写出反应的化学方程式,再把反应物和生成物的质量份数写在化学式的下方。( H-1 O-16 S-32 Fe-56 Cu-64 )
1. 硫在氧气中燃烧的反应:
2. 铁与硫酸铜溶液的反应:
3. 粗铜丝表面的氧化铜与氢气在加热条件下反应:
四、化学方程式的书写步骤
1、写:根据实验事实写出反应物和生成物的化学式;
2、配:配平化学方程式,在化学式前面添上适当的化学计量数,使各种元素的原子个数反应前后相等。
3、等:将短线改为等号。
4、标:标明反应条件和生成物的状态,气体用“↑”,沉淀物用“↓”。
五、判断化学方程式是否正确的方法:
一看化学式是否正确,物质是否真实存在;
二看反应能否进行(反应条件等);
三看配平,认真检查左右两边各原子个数是否相等;
四看是否漏标、错标↑、↓和反应条件。
练习、写出下列反应的化学方程式
(1)碳在氧气中燃烧 ;
(2)硫在氧气中燃烧 ;
(3)红磷在氧气中燃烧 ;
(4)铁丝在氧气中燃烧 ;
(5)氢气在氧气中燃烧 ;
(6)镁条在空气中燃烧 ;
(7)电解水 ;
(8)过氧化氢溶液中加入二氧化锰 ;
(9)氯酸钾和二氧化锰共热 ;
(10)加热高锰酸钾固体 ;
(11)铁和硫酸铜溶液反应 ;
(12)碳酸钠和稀盐酸反应 。
———END———
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,一年会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: Lgxmw666